

說明:本文介紹了電化學沉積的原理、步驟、分類及分析方法。電化學沉積過程包括物質輸運、電荷轉移和表面過程。根據(jù)電源和反應機制,分為電化學沉積、無電沉積、電泳沉積和位移沉積。常用的分析方法有循環(huán)伏安法、計時安培法和電化學阻抗譜,用于研究沉積過程的動力學和機理。
什么是電化學沉積?
電化學沉積是一種通過施加外部電場,驅動電解液中的離子發(fā)生還原反應,從而在導電基底(陰極)表面形成一層固體薄膜或涂層的過程。其本質上是發(fā)生在陰極表面的還原反應。整個過程可以用簡單的半反應式來表示:
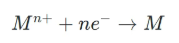
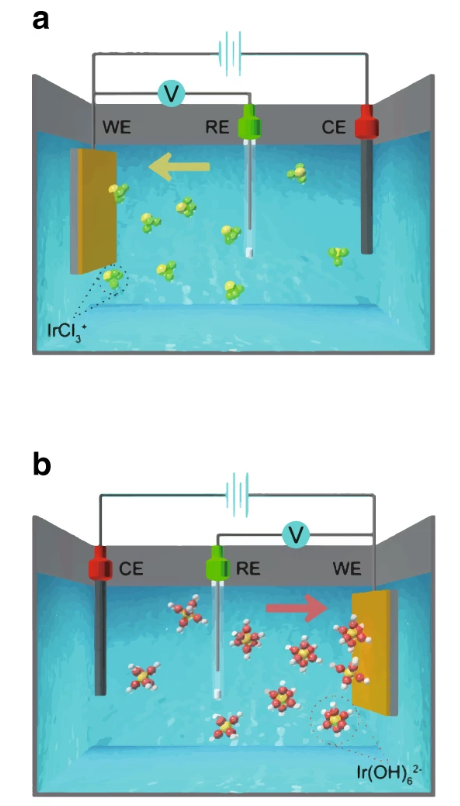
圖1. 電化學沉積過程中離子遷移與陰極還原沉積示意圖。DOI: 10.1038/s41467-020-14917-6。
典型的電化學沉積系統(tǒng)由以下四個基本部分組成(圖2):
陰極:也稱工作電極,是待沉積的基底,連接電源的負極。溶液中的金屬陽離子在陰極表面獲得電子,被還原成金屬原子,并沉積在基底上。
陽極:也稱為對電極,連接電源的正極,用來構成完整的電流回路。陽極可以是可溶性陽極,如在鍍銅中使用銅陽極,陽極自身發(fā)生氧化溶解,補充溶液中消耗的銅離子,也可以是惰性陽極,如鉑或石墨,其表面發(fā)生的是溶液中其他物質的氧化反應,如水的分解產氧。
電解液:含有待沉積物質離子的導電溶液。它不僅僅是離子的來源,其組分、濃度、pH值、添加劑等都會深刻影響沉積層的最終性質 。
外接電源:提供驅動整個電化學反應所需的電勢或電流。可以是直流電源,也可以是更復雜的脈沖電源或交流電源。
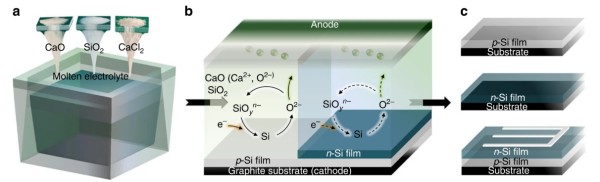
圖2. 典型電化學沉積體系及沉積過程示意圖。DOI: 10.1038/s41467-019-13065-w。
電化學沉積的步驟?
物質輸運
離子通過擴散、電遷和對流三種方式從電解液主體遷移到陰極表面附近。
擴散是由于陰極表面離子被消耗產生濃度梯度,離子自發(fā)地從高濃度區(qū)向低濃度區(qū)移動;電遷是帶電離子在電場作用下向相應電極移動;對流則是通過機械攪拌等方式宏觀移動溶液,將富含離子的溶液帶到電極表面(圖3)。
圖3. 溶液主體-擴散層-反應界面示意圖。DOI: 10.1038/s41467-024-46980-8。
電荷轉移
當離子到達陰極表面的雙電層區(qū)域后,離子從陰極獲取電子,擺脫溶劑化外殼,并轉化為中性的吸附原子。反應速度則速度由巴特勒-沃爾默方程所描述,其難易程度與電極材料、離子種類和過電勢大小密切相關(圖4)。
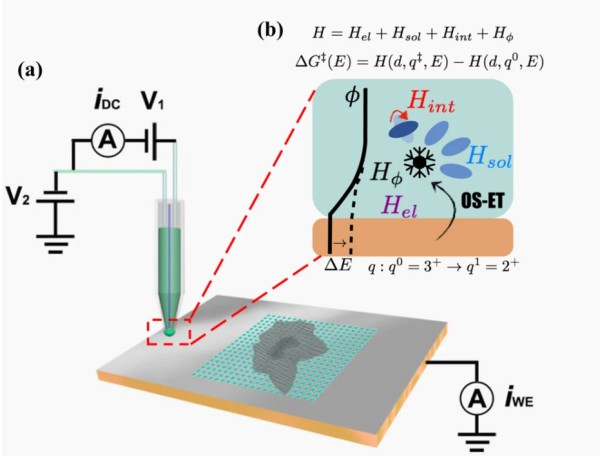
圖4. 電荷轉移能壘與界面微觀相互作用示意圖。DOI: 10.1038/s41467-021-27339-9。
表面過程
新生成的吸附原子不會立即固定于基底表面,而會在表面進行二維擴散,來尋找能量最低的位置并嵌入晶格中,這一過程被稱為晶體生長。在沉積的初始階段,吸附原子聚集形成穩(wěn)定的晶核(成核)。
這兩個過程共同決定了沉積層的微觀結構、晶粒尺寸、表面形貌以及最終的物理化學性質(圖5)。
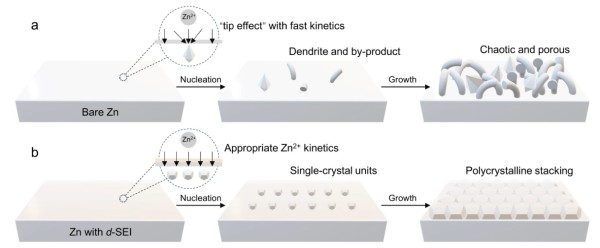
圖5. 金屬Zn在多晶/單晶等不同基底上的成核位置、晶核長大方向以及最終電沉積形貌流程示意圖。DOI: 10.1038/s41467-025-58063-3。
電化學沉積有哪些分類?
電化學沉積
電化學沉積需依賴外部電源來提供電子,驅動非自發(fā)的氧化還原反應(圖6),包括陰極沉積和陽極沉積。
陰極沉積:工作電極為陰極,電解液中的陽離子在陰極表面得到電子被還原成金屬原子。
陽極沉積:工作電極為陽極,發(fā)生氧化反應形成沉積物。例如,在特定條件下,可以通過陽極氧化金屬鉛(Pb)生成二氧化鉛薄膜。
圖6. 電化學沉積中陽極沉積與陰極沉積機理的示意圖。DOI: 10.1021/cm504806p。
無電沉積
無電沉積不需要外部電源。沉積的驅動力來自于電解液中化學還原劑與金屬離子之間自發(fā)的氧化還原反應。
自催化沉積是無電沉積的主要形式。在基底表面沉積的第一層金屬作為后續(xù)還原反應的催化劑,促使沉積過程可以持續(xù)進行。無電沉積的優(yōu)勢是可以在非導電基底上形成均勻的金屬層(圖7)。
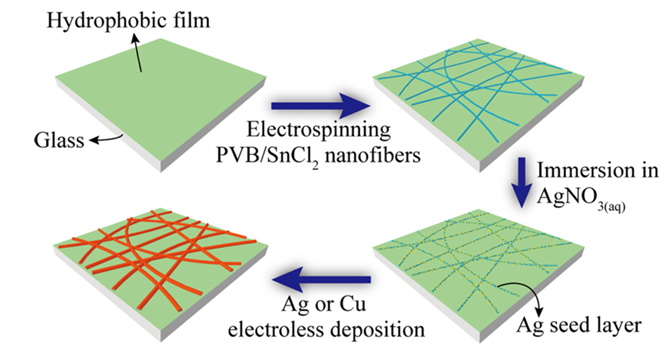
圖7. 化學沉積金屬靜電紡納米線透明電極示意圖。DOI: 10.1021/ja505741e。
電泳沉積
與離子還原不同,電泳沉積的物種是帶電的膠體顆粒。在電場作用下,懸浮在液體介質中的帶電顆粒會定向遷移到帶有相反電荷的電極上并緊密堆積形成一層薄膜。電泳沉積廣泛用于制備陶瓷涂層、復合材料以及功能性薄膜(圖8)。
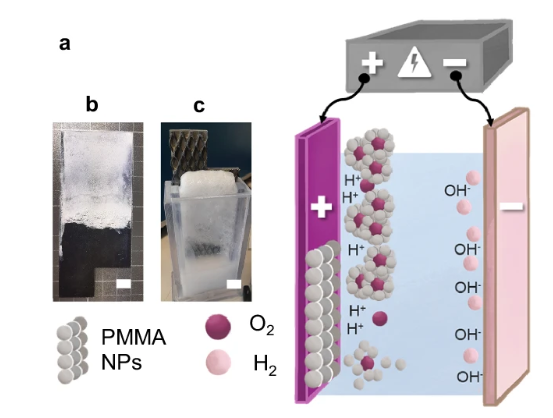
圖8. 納米塑料在電場下的電泳分離及后續(xù)泡沫捕獲過程。DOI: 10.1038/s41467-024-48142-2。
位移沉積
位移沉積也被稱為浸漬沉積,通過利用金屬活動性順序的差異。將較不活潑的金屬浸入含有更活潑金屬離子的溶液中,基底金屬會自發(fā)地溶解氧化,同時溶液中的金屬離子被還原并沉積在基底表面(圖9)。
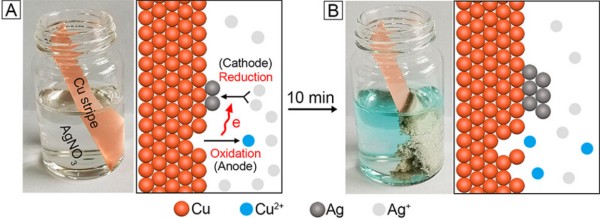
圖9. Cu條浸入AgNO3溶液的置換沉積示意圖。DOI: 10.1021/acs.accounts.3c00067。
如何分析電化學沉積過程?
循環(huán)伏安法 (CV)
通過對工作電極施加一個三角波形的掃描電壓,即電位從一個起始點線性掃描到一個折返點,然后再反向線性掃描回起始點,循環(huán)多次記錄下流過工作電極的電流隨外加電位的變化,得到電流-電位曲線(圖10)。
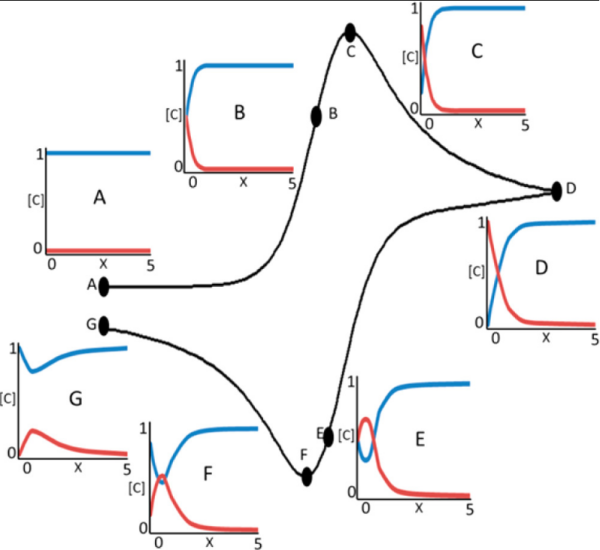
圖10. 在可逆循環(huán)伏安波的各個階段,濃度與距電極的距離的關系。DOI: 10.1021/ic500658x。
陰極峰和陽極峰的位置可判斷反應發(fā)生的大致電位區(qū)間。通過峰電位差(ΔEp)和峰電流比(Ipa/Ipc)可以判斷反應的可逆程度。峰電流隨掃描速率的變化關系,可以初步判斷反應是受擴散控制還是表面吸附控制。
計時安培法(I-t)
計時安培法是通過調整電位階躍到足以引發(fā)沉積的值,來記錄電流隨時間的變化。通過與理論模型(如Scharifker-Hills模型)進行擬合,可以判斷成核是瞬時成核還是連續(xù)成核(圖11)。
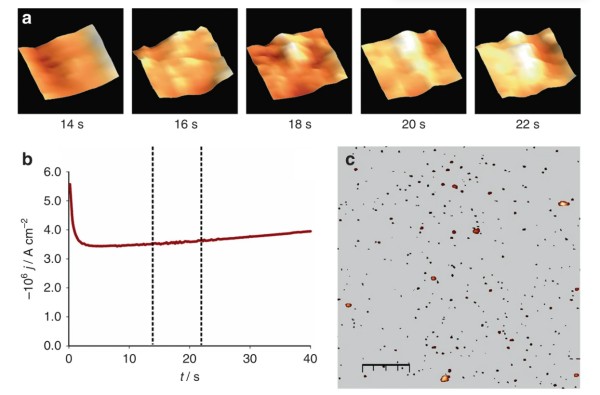
圖11. 在一定過電位下記錄的電流–時間曲線及AFM圖像展示單個銅核的成核與生長過程。DOI: 10.1038/s41467-017-01087-1。
電化學阻抗譜 (EIS)
通過向體系施加一個微小的正弦交流電位擾動,測量其電流響應,從而得到電化學體系的阻抗信息。通過對不同頻率下的阻抗數(shù)據(jù)進行等效電路擬合,可以定量地解析出體系的各個物理化學參數(shù)(圖12)。例如:
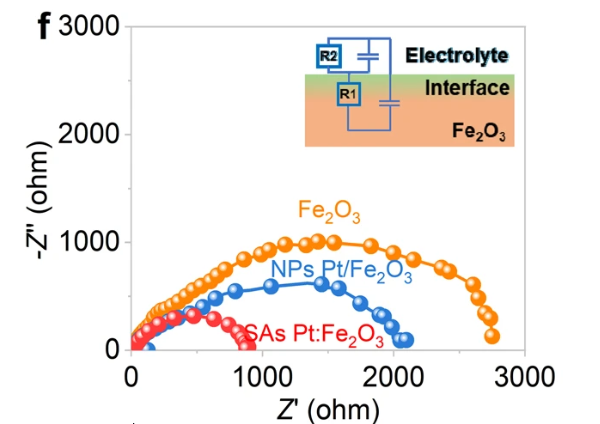
圖12. 多個樣品在1.23 VRHE下的Nyquist圖。DOI: 10.1038/s41467-023-38343-6。
溶液電阻(Rs)反映了電解液的導電能力。
電荷轉移電阻(Rct)能直接反映電荷轉移步驟的動力學快慢。
雙電層電容(Cdl)反映了電極/溶液界面的結構。
擴散阻抗(Warburg)則能反映離子擴散的難易程度。
通過實時監(jiān)測這些阻抗參數(shù)的變化,EIS能動態(tài)追蹤電沉積的演變。例如,電荷轉移電阻的降低可能意味著沉積加速;表面粗糙度增加會導致雙電層電容行為偏離理想狀態(tài);特定頻率的響應則可揭示添加劑的作用機理或枝晶生長的早期跡象。

